简介
凝血因子Ⅴ(F5)是凝血系统的一种蛋白质,由六个结构域组成:A1-A2-B-A3-C1-C2,与其他大多数凝血因子相比,它没有酶的活性,而是作为一种辅助因子发挥作用,缺陷会导致出血的倾向,而一些突变(最明显的是F5 Leiden)则容易导致血栓形成,F5的基因位于第一条染色体(1q24),它在基因组上与多铜氧化酶家族有关,并与凝血因子VIII同源。
检测原理
本试剂盒采用双抗体夹心法ELISA技术 : 将捕获抗体包被于酶标板上,捕获样品及标准品中的待测物F5,清洗后,再加入生物素标记的检测抗体进行孵育后清洗,形成“捕获抗体-抗原-检测抗体”免疫复合物,随后加入链霉亲和素偶联的辣根过氧化物酶进行孵育,待孵育结束后清洗,接着加入TMB显色后,若样本中有待测物则显蓝色,加入终止液停止反应。检测过程中游离的成分均被洗去,用酶标仪在450 nm处测OD值,颜色的深浅和样品中的待测物的含量呈正比,通过绘制标准曲线计算出样本中F5的浓度。
需要的其他材料
1. 酶标仪,包含450nm测定波长,同时包含600-680nm校正波长更佳;
2. 移液器及枪头;
3. 蒸馏水或去离子水;
4. 100-1000 mL刻度量筒;
5. 洗瓶、排枪或自动微孔板清洗机;
6. 水平轨道微孔板振荡器,能够保持500±50 rpm的速度;
7. 用于稀释标准品和样品的试管。
样品保存
样品收集后若在 1 周内进行检测的可保存于4℃,若不能及时检测,请按一次使用量分装,冻存于-20℃(1个月内检测),或-80℃(6个月内检测),避免反复冻融,标本溶血会影响最后检测结果,因此溶血标本不宜进行此项检测。
试剂准备工作
使用前将所有试剂置于室温平衡30分钟左右。
洗涤液/稀释液配置
如果洗涤液/稀释液(20×)有晶体析出,需在37℃下加热⾄晶体全部溶解。用蒸馏水1:20稀释(例如:1mL 浓缩洗涤液加入19mL的蒸馏水)
标准品配置
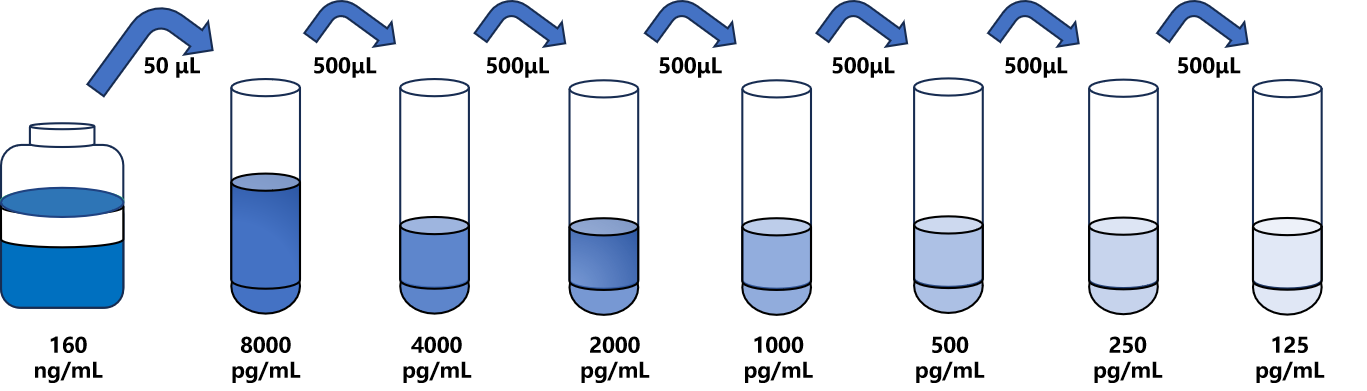
试剂盒中取出标准品,准备7个试管,先从160ng/mL标准品(200μL)按需吸取一定量用1×稀释液稀释至8000pg/mL(例:50μL的标准品母液+950μL的1×稀释液,制备得到1000μL的8000pg/mL浓度标准品),随后在6个试管中分别加入500μL的1×稀释液,在这6个单独的试管中将8000pg/mL标准品依次2倍倍比稀释至6个梯度,共配制7个浓度的标准品,依次为: 8000pg/mL、 4000pg/mL、 2000pg/mL、 1000pg/mL、 500pg/mL、 250pg/mL、 125pg/mL,从最高浓度标准品溶液中吸取500μL标准品到下一个试管中,轻轻吹打混匀,以此类推进行标准品的倍比稀释(如图所示),1×稀释液用作零浓度标准品(0pg/mL)。
抗体工作液配置
使用前10分钟,将100×生物素化抗体于1000×g离心1分钟,随后用1×稀释液将100×生物素化抗体稀释成1×生物素化抗体工作液,根据所需用量当日配置当日使用。
酶结合物工作液配置
使用前10分钟,将100×SA-HRP溶液于1000×g离心1分钟,随后用1×稀释液将100×SA-HRP稀释成1×SA-HRP工作液,根据所需用量配置。
备 注:如待测样本中F5浓度高于标准品最高值,请根据实际情况选择适当的稀释倍数。
结果的计算
计算标准品和样本复孔的平均OD值并减去空白孔的OD值作为校正值。以浓度为横坐标,OD值为纵坐标,在坐标纸上绘出四参数逻辑函数的标准曲线(作图时去掉空白组的值)。或者使用能够生成四参数逻辑(4-P)曲线拟合的计算机软件来创建标准曲线。若样品OD值高于标准曲线上限,应适当稀释后重测并在计算样本浓度时乘以相应的稀释倍数。
示例数据
标准品浓度(pg/mL)
8000
4000
2000
1000
500
250
125
0
OD值
2.589
1.772
0.984
0.663
0.485
0.213
0.131
0.059
2.530
1.713
0.925
0.604
0.426
0.154
0.072
0
以下数据和曲线仅供参考,实验者需根据自己的实验数据建立标准曲线。
下图所示标准曲线仅供示例,结果计算应以同次试验标准品所绘标准曲线为准计算样本结果

重复性
板内变异系数小于10%,板间变异系数小于10%。
灵敏度
经样本测试,本试剂盒的检测灵敏度为62.5pg/mL。
特异性
该试剂盒测定可识别重组小鼠F5。
其他相关蛋白在稀释缓冲液中制备为50ng/mL,并测定交叉反应性。没有观察到明显的交叉反应。
使用ELISA试剂盒之前,请您必须完整阅读说明书,本产品仅供科研使用,不得用于临床诊断和治疗。
 购物车
购物车 帮助
帮助
 021-54845833/15800441009
021-54845833/15800441009
